Mg характеристика – характеристика элемента Mg, химия
Магний (Mg, Magnesium) — влияние на организм, польза и вред, описание
История магния
Магний в виде металла был впервые получен Гемфри Дэви в 1808 году. Английский химик проводил процесс электролиза между влажной смесью белой магнезии и оксидом ртути, в результате чего получил сплав ртути с неизвестным металлом (амальгаму). После выгонки ртути Дэви получил новое вещество – порошок металла, который был назван магнием (calorizator). Через два десятилетия, в 1828 году француз А.Бюсси получил чистый металлический магний.
Общая характеристика магния
Магний является элементом главной подгруппы II группы III периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 12 и атомную массу 24,305. Принятое обозначение – Mg (от латинского Magnesium).

Нахождение в природе
По количеству содержания в земной коре магний занимает 8-е место среди минеральных веществ, он очень распространён. Природными источниками магния являются морская вода, ископаемые минеральные отложения и рассолы.
Физические и химические свойства
Магний является лёгким и ковким металлом, его цвет – серебристо-белый с явным металлическим блеском. В обычном состоянии покрыт плёнкой оксида магния, которую можно разрушить, нагрев металл до 600-650˚С. Магний сгорает, выделяя ослепительно белое пламя и образуя оксид и нитрид магния.

Суточная потребность в магнии
Суточная потребность в магнии зависит от возраста, пола и физического состояния человека. Для здорового взрослого человека составляет от 400 до 500 мг.
Продукты питания богатые магнием
В продуктах питания содержится различное количество магния, расположим их по мере убывания содержания полезного микроэлемента:
- крупы (пшено и гречка)
- горох, фасоль, лесные орехи, тахинная халва
- сухое молоко, арбуз, пшеничные отруби, шпинат, соевая мука
- ржаной хлеб, абрикосы, лимон, грейпфрут
- печень говяжья, мясо кролика, свинина
- пшеничный хлеб, кукуруза, морковь, салат
- молочные продукты, рыба, яйца
- картофель, репчатый лук, белокочанная капуста
- томаты, зелёный лук, свёкла
- яблоки, сливы.
Усвояемость магния
Всасывание органических соединений магния в основном происходит в двенадцатиперстной и толстой кишках, при чрезмерном употреблении кофеина, алкоголя и калия организм теряет значительную часть магния с мочой.
Взаимодействие с другими
Для организма важен баланс между кальцием и магнием, потому что именно эти минералы отвечают за нормальное состояние костной ткани и зубов. В аптечных витаминно-минеральных комплексах количество кальция и магния содержится в оптимальных количествах.
Натрий, магний и фосфор регулируют процессы в нервной системе и отвечают за мышечную активность. Обменные процессы магния в организме происходят с помощью витаминов В6, D, Е и калия.
Признаки нехватки магния
Нехватку магния в организме могут вызвать болезни почек, расстройство желудка, приём мочегонных средств и некоторых контрацептивов, чрезмерное увлечение алкоголем и кофеином. Признаками нехватки магния считают бессонницу, раздражительность, головокружения, нарушения сердцебиения и скачки кровяного давления, частые головные боли, чувство усталости, мерцающие точки перед глазами, судороги, мышечные спазмы, выпадение волос.
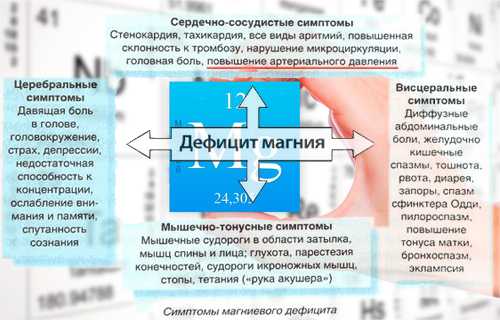
Признаки избытка магния
Признаками избытка магния считают:
- понос, тошноту, рвоту
- сонливость, замедление пульса
- нарушения координации, речи
- высыхание слизистых (во рту и носу).
Полезные свойства магния и его влияние на организм
Магний важен для эффективного функционирования нервов и мышц, важен для превращения сахара крови в энергию. Магний поддерживает здоровое состояние зубов, помогает предупредить отложения кальция, камни в почках и желчном пузыре, приносит облегчение при несварении. Организм человека содержит приблизительно 21 г магния.
Магний нормализует деятельность сердечно-сосудистой и эндокринной систем организма, функции головного мозга, оказывает помощь при выведении токсинов и тяжёлых металлов.
Применение магния в жизни
Соединения магния (сплавы) используются в самолётостроении и автомобильном производстве из-за прочности и лёгкости магниевых сплавов. Магний применяется как химический источник тока, в медицине, военном деле, в фотографии.

Автор: Виктория Н. (специально для Calorizator.ru)
Копирование данной статьи целиком или частично запрещено.
www.calorizator.ru
Помогите написать характеристику Mg (магния)!!!
Ма́гний — элемент главной подгруппы второй группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 12. Обозначается символом Mg (лат. Magnesium). Простое вещество магний (CAS-номер: 7439-95-4) — лёгкий, ковкий металл серебристо-белого цвета.Получение
Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl2 (бишофит) , натрия NaCl и калия KCl. В расплаве электрохимическому восстановлению подвергается хлорид магния:
MgCl2 (электролиз) = Mg + Cl2.
Расплавленный металл периодически отбирают из электролизной ванны, а в нее добавляют новые порции магнийсодержащего сырья. Так как полученный таким способом магний содержит сравнительно много (около 0,1 % примесей) , при необходимости «сырой» магний подвергают дополнительной очистке. С этой целью используют электролитическое рафинирование, переплавку в вакууме с использованием специальных добавок — флюсов, которые «отнимают» примеси от магния или перегонку (сублимацию) металла в вакууме. Чистота рафинированного магния достигает 99,999 % и выше.
Разработан и другой способ получения магния — термический. В этом случае для восстановления оксида магния при высокой температуре используют кремний или кокс:
MgO + C = Mg + CO
Применение кремния позволяет получать магний из такого сырья, как доломит CaCO3·MgCO3, не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции:
CaCO3·MgCO3 = CaO + MgO + 2CO2,
2MgO + CaO + Si = CaSiO3 + 2Mg.
Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырьё, но и морскую воду.
[править] Физические свойства
Магний — металл серебристо-белого цвета с гексагональной решёткой (a=3,21 Å c=5,21 Å). При обычных условиях поверхность магния покрыта прочной защитной плёнкой оксида магния MgO, которая разрушается при нагреве на воздухе до примерно 600 °C, после чего металл сгорает с ослепительно белым пламенем с образованием оксида и нитрида магния Mg3N2. Плотность магния при 20 °C — 1,74 г/см³, температура плавления металла tпл = 650 °C, температура кипения — tкип = 1105 °C, теплопроводность при 20 °C — 156 Вт/(м·К) . Магний высокой чистоты пластичен, хорошо прессуется, прокатывается и поддается обработке резанием.
[править] Химические свойства
Смесь порошкового магния с перманганатом калия KMnO4 — взрывчатое вещество
Раскаленный магний реагирует с водой:
Mg (раск. ) + Н2О = MgO + h3↑;
Щелочи на магний не действуют, в кислотах он растворяется легко с выделением водорода:
Mg + 2HCl = MgCl2 + h3;
При нагревании на воздухе магний сгорает, с образованием оксида, также с азотом может образовываться небольшое количество нитрида:
2Mg + О2 = 2MgO;
3Mg + N2 = Mg3N2
otvet.mail.ru
Магний и его характеристики
Общая характеристика магния
Магний весьма распространен в природе. В больших количествах он встречается в виде карбоната магния, образуя минералы магнезит MgCO3 и доломит MgCO3×CaCO3. Сульфат и хлорид магния входят в состав минералов каинита KCl×MgSO
В виде простого вещества магний представляет собой серебристо-белый (рис. 1), очень легкий металл. На воздухе он мало изменяется, так как быстро покрывается тонким слоем оксида, защищающего его от дальнейшего окисления.

Рис. 1. Магний. Внешний вид.
Атомная и молекулярная масса магния
Относительной молекулярная масса вещества (Mr) – это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента (Ar) — во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода.
Поскольку в свободном состоянии магний существует в виде одноатомных молекул Mg, значения его атомной и молекулярной масс совпадают. Они равны 24,304.
Изотопы магния
Известно, что в природе магний может находиться в виде трех стабильных изотопов 24Mg (23,99%), 25Mg (24,99%) и 26Mg (25,98%). Их массовые числа равны 24, 25 и 26 соответственно. Ядро атома изотопа магния 24Mg содержит двенадцать протонов и двенадцать нейтронов, а изотопов 25Mg и 26Mg– такое же количество протонов, тринадцать и четырнадцать нейтронов соответственно.
Существуют искусственные изотопы магния с массовыми числами от 5-ти до 23-х и от 27-ми до 40-ка.
Ионы магния
На внешнем энергетическом уровне атома магния имеется два электрона, которые являются валентными:
1s22s22p63s2.
В результате химического взаимодействия маний отдает свои валентные электроны, т.е. является их донором, и превращается в положительно заряженный ион:
Mg0-2e → Mg2+.
Молекула и атом магния
В свободном состоянии магний существует в виде одноатомных молекул Mg. Приведем некоторые свойства, характеризующие атом и молекулу магния:
|
Энергия ионизации атома, эВ |
7,65 |
|
Относительная электроотрицательность |
1,31 |
|
Радиус атома, нм |
0,160 |
|
Стандартная энтальпия диссоциации молекул при 25oС, кДж/моль |
150,2 |
Сплавы магния
Главная область применения металлического магния – это получение на его основе различных легких сплавов. Прибавка к магнию небольших количеств других металлов резко изменяет его механические свойства, сообщая сплаву значительную твердость, прочность и сопротивляемость коррозии.
Особенно ценными свойствами обладают сплавы, называемые электронами. Они относятся к трем системам: Mg-Al-Zn, Mg-Mn и Mg-Zn-Zr. Наиболее широкое применение имеют сплавы системы Mg-Al-Zn, содержащие от 3 до 10% алюминия и от 0,2 до 3% цинка. Достоинством магниевых сплавов является их малая плотность (около 1,8 г/см 3).
Примеры решения задач
ru.solverbook.com
| Національний університет “Києво-Могилянська Академія” Реферат з курсу основи мембранології тема: Характеристика Mg2+ -залежної Сa2+-активованої ATPази плазматичних мембран. Студентки І курсу МП Біологія Дудник Ірини Київ 1999
Вступ: функціональна роль Ca2+, Mg 2+— ATPази плазматичних мембран. Іони кальцію контролюють багато важливих фізіологічних функцій клітини, таких, як електрохімічне спряження при м’язевому скороченні, проникність мембран для іонів натрію та калію, впливають на роботу іонних насосів, регулюють роботу ферментів. Внутрішньоклітинна концентрація кальцію на чотири порядки нижча від зовнішньоклітинної; такий високий градієнт концентрації досягається завдяки функціонуванню АТР- залежних кальцієвих помп. Результати досліджень енергозалежних Са2+-транспортуючих систем вказують на існування двох типів Са2+-помп: це Са2+ — помпи ендоплазматичного ретикулуму та плазматичних мембран. Ці системи характеризуються високою спорідненістю до Са2+, що відповідає концентрації цього катіона в клітині в незбудженому стані. Для м’язів з добре розвиненим ендоплазматичним ретикулумом (серцевий, скелетні, гладенькі м’язи великих судин, подвздошної кишки) значну роль в регуляції цитоплазматичної концентрації іонів Са2+ може виконувати Са2+-помпа саме саркоплазматичного ретикулуму. Але в клітинах гладеньких м’язів ендоплазматичний ретикулум розвинений набагато гірше, ніж в скелетних та серцевих, і для більшості таких клітин величина поверхні ендоплазматичного ретикулуму складає 10 % від поверхні плазматичної мембрани. Тому є підстави вважати, що більш суттєва роль в регуляції внутрішньоклітинної концентрації іонів Са2+ в гладеньком’язовій клітині належить саме Са2+-транспортуючій системі плазматичної мембрани. Тонічне скорочення міометрію визначається базальним потоком іонів Са2+, який входить в незбуджені міоцити за фізіологічних умов, і цей вхід компенсується кальцієвою помпою сарколеми. Таким чином, Са2+-помпа плазматичних мембран не тільки контролює процес розслаблення гладенького м’язу, але і забезпечує довготривалий трансмембранний обмін Са2+, підтримуючи стаціонарне значення концентрації іонів Са2+ в міоцитах на рівні 10-7— 10-6 М, компенсуючи повільне базальне дифузійне надходження цього катіону в цитоплазму із зовнішньоклітинного простору і регулюючи міогенний тонус м‘язу. Уявлення про вузьке розповсюдження Са2+, Mg2+— АТРази були спростовані лише в 1978 році, коли Ді Поло та його співробітники описали АТР-залежний транспорт Са2+ крізь плазматичні мембрани типових збудливих клітин — гігантських аксонів кальмара. За короткий час присутність Са2+, Mg2+— АТРази була доведена для плазматичних мембран багатьох клітин – скелетних, гладеньких м’язів та серцевих м’язів, клітин залозистих тканин, мозку та клітин. За сучасними даними Са2+, Mg2+— АТРаза плазматичних мембран відноситься до числа найбільш широко розповсюджених ферментних систем та є невід’ємним білковим компонентом плазматичної мембрани клітин еукаріот. Перші найбільш загальні відомості про будову та функції Са2+, Mg2+— АТРази плазматичних мембран були отримані при дослідженні ферменту у складі нативної мембрани еритроцитів. Однією з найважливіших характеристик АТР-гідролазної системи є механізм гідролізу АТР. За цією ознакою всі відомі АТРази розділяють на два основних типи. АТРази першого типу (F та V-АТРази) здійснюють реакцію гідролізу АТР шляхом прямого переносу γ-фосфату молекули АТР на молекулу води. Ферменти другого типу – Р-АТРази або Е1-Е2-АТРази — під час гідролізу АТР утворюють проміжну фосфорильовану форму ферменту. Вони переносять γ-фосфат молекули АТР на фермент з утворенням ковалентного ацилфосфатного зв’язку з бічною карбоксильною групою амінокислотного залишку білку, а потім шляхом гідролізу цього зв’язку на молекулу води. Дослідження функціональних властивостей Са2+, Mg2+— АТРази плазматичних мембран продемонстрували її приналежність до ферментів Е1-Е2 типу. При підвищенні концентрації іонів Са2+ в цитоплазмі відбувається зв’язування катіонів з ферментом, який знаходиться у формі Е1-конформації, що характеризується високою спорідненістю до Са2+. Відбувається Са2+-залежний перенос γ-фосфату молекули АТР на молекулу ферменту та утворення фосфорильованого продукту Е1-Р. На стадії фосфорильованого ферменту відбувається конформаційна перебудова білка у форму Е2-Р. На стадії конформеру Е2-Р спорідненість Са2+, Mg2+— АТРази до іонів Са2+ падає на декілька порядків. Результатом такого конформаційного переходу є вивільнення Са2+ у зовнішньоклітинний простір. Завершується реакційний цикл Mg2+-залежним дефосфорилюванням Са2+, Mg2+— АТРази та перетворенням ферменту у форму Е1 (Рис.1). Рисунок 1. АТР + Е1 Е1 — Р + АDР Са2+ Рі — неорганічний фосфат. Доступність солюбілізованої форми даного ферменту надала можливість визначення первинної структури молекули Са2+, Mg2+— АТРази, що дало змогу остаточного докорінного аналізу всіх його властивостей. Вперше повна амінокислотна послідовність Са2+, Mg2+— АТРази плазматичних мембран клітин людини була встановлена в 1988 році. Для аналізу нуклеотидної послідовності було використано ген ферменту з сДНК банку тератокарциноми прямої кишки людини. Закодована послідовність складалась з 1220 амінокислотних залишків, що утворюють поліпептид молекулярною вагою 134 683 Да. В будові ферменту були знайдені великі ділянки структурної подібності з іншими іонтранспортуючими Е1-Е2-АТРазами. До таких ділянок відносяться : 1) пептидна ділянка навколо амінокислотного залишку Asp-475, який фосфорилюється під час реакційного циклу; 2) FITC (АТР)- зв’язуюча ділянка; 3) пептидна ділянка, що розміщена між двома попередніми, яка забезпечує їх просторове зближення та ін. Наявність цих гомологічних та висококонсервативних ділянок в структурі Е1-Е2-АТРаз, напевно, обумовлено їх участю у найважливіших та загальних для всіх АТРаз етапах функціонування. Молекула містить 10 трансмембранних сегментів, що з’єднані на зовнішньоклітинній поверхні плазматичної мембрани досить короткими петлями. На внутрішньоклітинному боці плазматичної мембрани фермент утворює якнайменше дві довгі гідрофільні петлі (між другим та третім, четвертим та п’ятим гіфдрофобними сегментами). До складу другої петлі входять АТР-фосфорилюємий та АТР зв’язуючий сегменти каталітичного ферментативного центру. Функціональна роль першої петлі поки що не з’ясована. По аналогії з іншими Е1-Е2-АТРазами вона може брати участь у спряженні процесів транслокації катіонів та гідролізу АТР. Слід зазначити, що до складу цієї петлі входить також суто специфічний для Са2+, Mg2+— АТРази фрагмент, який напевно є регуляторним центром ферменту, що є чутливим до фосфоліпідів. В середину клітини також експоновані N- та C — кінцеві ділянки Са2+, Mg2+— АТРази. Функціональна роль N-кінцевого сегменту остаточно не з’ясована, але наявність в ній великої кількості негативно заряджених амінокислотних залишків дає підстави вважати, що він бере участь у процесі безпосереднього зв’язування з іонами Са2+. С-кінцевий сегмент без сумніву є регуляторним, оскільки тут розташовані кальмодулінзв’язуюча аутоінгібіторна ділянка, сегмент регуляторного фосфорилювання ферменту сАМР-залежною протеїнкіназою. Області навколо кальмодулінзв’язуючої ділянки білка також багаті на від’ємно заряджені амінокислотні залишки, що дає підставу розглядати їх в якості центрів зв’язування та транслокації катіонів. В 1988 році була висунута гіпотеза про існування декількох ізоформ Са2+, Mg2+— АТРази плазматичних мембран при співставленні даних про первинну структуру ферменту, отриманих за допомогою методів генної інженерії та білкової хімії. Було показано, що Са2+, Mg2+— АТРаза плазматичних мембран тератокарциноми людини (hPMCA 1) відрізняється за будовою від Са2+, Mg2+— АТРази мембран еритроцитів людини. З 184 амінокислотних залишків, що входять до складу структурно охарактеризованих пептидних фрагментів Са2+, Mg2+— АТРази еритроцитів, лише 158 залишків були ідентичні відповідним амінокислотним залишкам Са2+, Mg2+— АТРази плазматичних мембран тератокарциноми . Пызныше Шал та Гріб описали три різні ізоформи Са2+, Mg2+— АТРази плазматичних мембран з бібліотеки сДНК мозку щурів: rPMCA 1 та rPMCA 2 (rPMCA 3). Всі три ізоформи кодувались окремими генами. Одна з ізоформ Са2+, Mg2+— АТРази плазматичних мембран клітин мозку щурів (rPMCA 1) складалась з 1176 амінокислотних залишків та мала молекулярну вагу 129500 Да. Її перші 1117 амінокислотних залишків на 99 % були ідентичні трохи раніше описаній ізоформі Са2+, Mg2+— АТРази плазматичних мембран тератокарциноми прямої кишки людини (hPMCA 1). Аналіз амінокислотних послідовностей дозволив зробити висновок про те, що обидві ізоформи є продуктами одного гену, а розбіжності в структурі С-кінцевих послідовностей є результатом альтернативного сплайсингу відповідних мРНК. Аналогічно було доведено, що ізоформи hPMCA 2 тератокарциноми прямої кишки людини та rPMCA 2 клітин мозку щурів та відповідні ізоформи hPMCA 3 клітин слизової оболонки кишечнику та rPMCA 3 клітин мозку щурів також є продуктами експресії окремих структурних генів. Слід зазначити, що при скринингу бібліотеки сДНК з мозку бика були знайдені фрагменти структурного гену ще однієї ізоформи Са2+, Mg2+— АТРази. ЇЇ структура досить істотно відрізняється від структури раніше описаних ізоформ, що є підстави говорити про існування четвертого структурного гену Са2+, Mg2+— АТРази плазматичних мембран. За допомогою Northern blot аналізу було доведено, що експресія PMCA 1-4 генів є органозалежною: так, продукти транскрипції гену PMCA 1 характеризуються найширшою розповсюдженістю та представляють головну репрезентативну ізоформу Са2+, Mg2+— АТРази плазматичних мембран. PMCA 2 ізоформа Са2+, Mg2+— АТРази переважно виявляється в плазматичних мембранах клітин мозку, серця та печінки, PMCA 3 – в плазматичних мембранах клітин мозку та скелетних м’язів. PMCA 4 ізоформа може бути експресована в еритроцитах та інтестінальних клітинах. Як вже було зазначено вище, первинні транскрипти кожного з генів можуть піддаватись альтернативному сплайсингу на 3’-кінці нуклеотидної послідовності. Існування великої різноманітності білкових продуктів гену PMCA 1 пояснюється виключенням, включенням або частковим включенням 3’-кінцевого екзону у нуклеотидну послідовність мРНК під час її дозрівання. Процес альтернативного сплайсингу може захоплювати ділянки РНК , які кодують функціонально важливі регуляторні центри ферменту, що знаходяться на С-кінці його поліпептидної послідовності. Зміна в структурній будові цих фрагментів є логічним поясненням існування форм Са2+, Mg2+— АТРаз, що відрізняються за чутливістю до кальмодуліну, ванадату, процесів фосфорилювання та ін. Отже, існування різноманітних за своїми функціональними та регуляторними властивостями форм Са2+, Mg2+— АТРаз плазматичних мембран пояснюється багаточисельністю кодуючих генів Са2+, Mg2+— АТРаз та існування можливості альтернативного сплайсингу РНК матриць одного й того ж структурного гену. Однак досить логічного пояснення явищу поліморфізму для Са2+, Mg2+— АТРаз плазматичних мембран, їх тканинної специфічності, розбіжності в їх функціональних та регуляторних властивостях поки що не знайдено. Каталітичні та кінетичні властивості очищеного ферменту. На ферменті з мембран еритроцитів було виявлено, що уявна спорідненість ферменту до Са2+ значно збільшувалась у присутності кальмодуліну при високій концентрації Mg2+ і менш реагувала на кальмодулін при низькій концентрації цього катіону (менше2 мМ). Найвища уявна спорідненість до Са2+ спостерігалась при рН 8,0 в присутності чи у відсутності кальмодуліну і прогресивно зменшувалась при наближенні до рН 6,0. Уявна спорідненість Са2+-транспортуючої АТРази мембран еритроцитів до кальмодуліну є досить високою: К0,5 по кальмодуліну становила біля 6 нМ незалежно від концентрації Mg2+. К0,5 по кальмодуліну Са2+, Mg2+— АТРази плазматичних мембран гладеньком’язових клітин шлунку складала 27,0 нМ. Для очищеного ферменту з мембран еритроцитів показана наявність двох КМ по MgATP: високої спорідненості та низької, що дорівнювали відповідно 7 та 140 мкМ. При мілімолярних концентраціях вільного Mg2+, перевищуючих концентрацію АТР, активність ферменту гальмувалась. Після перевірки в якості субстратів очищеної Са2+, Mg2+— АТРази плазматичних мембран клітин міометрію АТР, GTP, UTP, CTP, було показано, що фермент є строго специфічним відносно субстрату та гідролізує виключно молекулу АТР. Виявлено, що оптимум рН для Са2+, Mg2+— АТРази плазматичних мембран кардіоміоцитів 7,3, мембран еритроцитів – 7,0 – 7,25. Оптимальним для роботи очищеної Са2+, Mg2+— АТРази сарколеми міометрію є рН 7,5 – 8,0, в той час як для мембранної її форми оптимум рН знаходиться в діапазоні 6,4 – 7,0. Температурний оптимум для очищеної Са2+, Mg2+— АТРази плазматичних мембран еритроцитів спостерігався при 37 – 41 ОС, для Са2+, Mg2+— АТРази плазматичних мембран клітин міометрію – при 40 – 45 ОС. Підвищення температури до 50 ОС призводило до значного зниження активності очищеного ферменту. Регуляція ферменту внутрішньоклітинними факторами та фізіологічно активними речовинами. Регуляція Са2+, Mg2+— АТРази плазматичних мембран кальмодуліном. Перші відомості про регуляцію Са2+, Mg2+— АТРази плазматичних мембран кальмодуліном були отримані на початку 70-х років Бондом та Клау. В своїй роботі вченими було показано, що для переведення ферменту з менш активної форми А в більш активну форму В було необхідним додавання до виділених мембран не лише іонів Са2+ для моделювання реакції накопичення іонів Са2+, а також внутрішньоклітинного вмісту, який, напевно, містив “фактор активації”. Пізніше цей фактор було виділено, охарактеризовано та названо кальмодуліном. Кальмодулін — це невеликий термостабільний білок, що представлений одним поліпептидним ланцюгом молекулярною вагою 16,7 кДа. Цей білок є дуже консервативним: його амінокислотна послідовність є практично повністю ідентичною в ряду від безхребетних до вищих ссавців та людини. Така еволюційна консервативність є свідоцтвом виключно важливої ролі кальмодуліна як регулятора багатьох ферментних систем живих організмів. На цей час відомо понад два десятки кальмодулінзалежних білків. Вважається, що кальмодулін є універсальним регулятором більшості Са2+-залежних ферментів, але лише для Са2+, Mg2+— АТРази плазматичних мембран показана пряма регуляція кальмодуліном її активності через безпосередню взаємодію ферменту та активатора. Взаємодія Са2+, Mg2+— АТРази плазматичних мембран з кальмодуліном призводить до підвищення спорідненості системи до іонів Са2+ (у присутності кальмодуліна К0,5 для Са2+ = 0,5 мкМ, у відсутності — КМ для Са2+ = 10 — 20 мкМ) та 10-кратного підвищення швидкості гідролізу АТР та трансмембранного перенесення Са2+. Кальмодулінзв’язуючий сегмент Са2+, Mg2+— АТРази характеризується: 1) наявністю великої кількості позитивно заряджених залишків Arg та Lys та їх переважною локалізацією на N-кінцевій ділянці сегмента; 2) переважанням гідрофобних залишків на С-кінцевій ділянці сегмента; 3) наявністю залишку Trp та трьох залишків Ser відповідно на N- та С-кінцевих ділянках пептида. Сам кальмодулінзв’язуючий сегмент знаходиться, як вже було зазначено вище, в С-кінцевій області ферменту. Виходячи з подібних досліджень, було запропоновано можливий механізм взаємодії Са2+, Mg2+— АТРази з кальмодуліном: N-кінцевий сегмент кальмодулінзв’язуючого домену, збагачений залишками Arg та Lys, за відсутності кальмодуліна взаємодіє з високоафінним Са2+-зв’язуючим доменом, частково інактивуючи фермент. При додаванні кальмодуліна, активатор взаємодіє з кальмодулінзв’язуючим центром Са2+, Mg2+— АТРази, руйнуючи попередню взаємодію та вивільнюючи Са2+-зв’язуючий домен ферменту. Регуляторний вплив на Са2+, Mg2+— АТРазу кислих фосфоліпідів плазматичних мембран. Регуляторна дія кислих фосфоліпідів на активність Са2+, Mg2+-АТРази досліджувалась на препаратах виділеного та очищеного ферменту. До очищеної Са2+, Mg2+— АТРази плазматичних мембран додавались такі негативно заряджені фосфоліпіди: фосфатидилінозитол 4,5-бісфосфат (PtdIns4,5P2), фосфатидилінозитол 4-фосфат (PtdIns4P), фосфатидилінозитол (PtdIns), фосфатидилсерін (PtdSer) та фосфатидна кислота (PtdOH). Відносна ефективність впливу перелічених фосфоліпідів на активність солюбілізованої Са2+, Mg2+— АТРази розподілилась за таким рядом: PtdIns4,5P2> PtdIns4P > PtdIns = PtdSer = PtdOH [44]. Стимулюючий ефект кислих фосфоліпідів кінетично проявляється в майже 10-кратному підвищенні швидкості реакції (Vmax) транспортування катіонів та гідролізу АТР та спорідненості ферменту до іонів Са2+. Але регуляторний вплив кислих фосфоліпідів на Са2+, Mg2+— АТРазу є більш складним, оскільки дуже високі їх концентрації призводять до відчутного зниження Vmax. Також було підтверджено експериментально, що регуляторна дія кислих фосфоліпідів проявляється як в присутності, так і у відсутності кальмодуліна. Це дозволило зробити висновок про незалежність механізмів дії кальмодуліна та кислих фосфоліпідів на Са2+, Mg2+— АТРазу та відокремленість їх регуляторних центрів в молекулі білка. Вплив сАМР-залежної протеїнкінази та протеїнкіназои С на активність Са2+, Mg2+— АТРази плазматичних мембран. сАМР-залежний сайт фосфорилювання Са2+, Mg2+— АТРази плазматичних мембран еритроцитів знаходиться на С-кінці поліпептидного ланцюга збагаченого залишками серіну. Процес фосфорилювання сАМР-залежною протеїнкіназою Са2+, Mg2+— АТРази плазматичних мембран призводить до підвищення її активності: К0,5 для іонів Са2+ падає з 10 мкМ до 1,4 мкМ, а Vmax процесу гідролізу АТР зростає приблизно в 2 рази. На відміну від кальмодулін незалежного впливу кислих фосфоліпідів на активність Са2+, Mg2+— АТРази процес фосфорилювання ферменту сАМР-залежною протеїнкіназою чутливий до присутності кальмодуліна: кальмодулін запобігає процесу фосфорилювання та стимуляції Са2+, Mg2+— АТРази сАМР-залежною протеїнкіназою. Фосфорилювання Са2+, Mg2+— АТРази плазматичних мембран протеїнкіназою С також підвищує Vmax каталізуємої ферментом реакції та його спорідненість до іонів Са2+. Але на відміну від сАМР-залежної протеїнкінази вплив протеїнкінази С та кальмодуліна є аддитивними. Є дані про чутливість активності Са2+, Mg2+— АТРази фракції сарколеми гладеньм’язових клітин до фізіологічно активних та фармакологічних речовин – окситоцина, брадикініна, простагландинів, естрогенів та прогестерона, карбахола, сигетина. Окситоцин – це пептидний гормон, що складається з 9 амінокислотних залишків, синтезується в супраоптичних та паравентрикулярних ядрах гіпоталамусу та депонується в нейрогіпофізі. Окситоцин стимулює скорочення м’язових клітин матки та міоепітеліальних клітин молочних залоз. Під впливом цього гормону зростає амплітуда та частота скорочень клітин міометрію, підвищується тонус матки. Окситоцинові рецептори розміщені на поверхні плазматичних мембран клітин-мішеней. На жаль молекулярний механізм дії даного гормону поки що остаточно не з’ясований. Дослідженнями, проведеними на фракції плазматичних мембран клітин міометрію було продемонстровано, що окситоцин інгібує активність мембранозв’язаної Са2+, Mg2+— АТРази- введення окситоцину в середовище гомогенізації тканини міометрію призводить до зниження рівня АТР-залежної акумуляції іонів Са2+ в везикулах сарколеми, причому, інгібіторний вплив окситоцину на активність Са2+, Mg2+— АТРази проявлявся в присутності гормону саме всередині везикул сарколеми, тобто він опосередкований взаємодією гормону із специфічними рецепторами на зовнішньоклітинному боці плазматичної мембрани. Дослідження інгібіторного впливу окситоцину на мембранозв’язаний та очищений фермент за. різних концнтрацій гормону дає можливість передбачати, що окситоцин впливає на Са2+, Mg2+— АТРазу плазматичних мембран опосередковано через певні мембранні структури, наприклад гліколіпіди. Простагландини, гормоноподібні регуляторні молекули, похідні арахідонової та інших поліненасичених жирних кислот, досить широко використовуються в медичній практиці. Механізм дії простагландинів, що призводить до стимуляції скорочень міометрію майже не досліджений, але існує думка, що однією з причин стимуляції скоротливої активності міометрію під впливом цих сполук може бути підвищення концентрації внутрішньоклітинного Са2+ внаслідок інгібування простагландинами Са2+-помпи плазматичної мембрани. Показано, що простагландин Е2 та простагландин F2 інгібують Са2 На препараті солюбілізованого та очищеного ферменту простагландини Е2 та F2в діапазоні концентрацій +, Mg2+— АТРазну активність препарату плазматичних мембран міометрію. 10-8 – 10-4 М абсолютно не впливають на його активність. Такі дані очевидно пояснюються тим, що простагландини впливають на активність Са2+— транспортної АТРази плазматичних мембран не безпосередньо, а через рецептор та системи, що забезпечують спряження останнього з ферментом. ВИСНОВКИСа2+-помпа плазматичних мембран виконує дві основних функції: контролює процес розслаблення гладенького м’язу та забезпечує довготривалий трансмембранний обмін Са2+, підтримуючи стаціонарне значення концентрації іонів Са2+ в міоцитах на рівні 10-7— 10-6 М, компенсуючи повільне базальне дифузійне надходження цього катіону в цитоплазму із зовнішньоклітинного простору і регулюючи міогенний тонус м‘язу. Са2+-помпа плазматичної мембрани активується кальмодуліном і таким шляхом може брати участь в кальцієвій регуляції циклу скорочення-розслаблення гладеньком’язової клітини. Крім того, активність Са2+-помпи плазматичних мембран гладеньких м’язів (судин, матки) чутлива до змін мембранного потенціалу, кислих фосфоліпідів, фософрилювання протеїнкіназою С. Спорідненість Са2+, Mg2+— АТРази до іонів Са2+ набагато вища за спорідненість інших Са2+-трaнспортуючих систем – Na+ — Cа2+ обмінника та Cа2+ транспортної системи мітохондрій. Так, на міометрії показано, що К0,5 по Са2+ дорівнює для вищезгаданих систем 0,49, 50-60 та 4,07 мкМ відповідно. Крім того, Са2+, Mg2+— АТРаза плазматичних мембран гладеньком’язових клітин чутлива до дії деяких фізіологічних та фармакологічних речовин, регуляторів скорочення-розслаблення міоцитів. Інгібування Са2+-помпи плазматичної мембрани гладеньких м’зів окситоцином, простагландинами, сигетином та іншими речовинами, що активують скорочення гладеньких м’язів свідчить про участь цієї системи в контролі процесу розслаблення цих м’язів.
|
b.lekciya.com.ua
Характеристика магния. Химический элемент магний
Химический элемент магний — двенадцатый по счету в таблице Менделеева. Он относится к второй группе и третьему периоду. Он входит в совокупность щелочноземельных металлов. Наука, которая изучает эти элементы, — химия. Таблица Менделеева, опираясь на которую можно изучать данную науку, показывает нам, что протонов и нейтронов, содержащихся в атоме магния, по двенадцать. Это можно определить по порядковому номеру (он равен количеству протонов, а электронов будет столько же, если это нейтральный атом, а не ион).
Химические особенности магния также изучает химия. Таблица Менделеева также необходима для их рассмотрения, так как она показывает нам валентность элемента (в данном случае она равняется двум). Она зависит от группы, к которой относится атом. Кроме того, с ее помощью можно узнать, что молярная масса магния равняется двадцати четырем. То есть один моль данного металла весит двадцать четыре грамма. Формула магния очень проста — он состоит не из молекул, а из атомов, объединенных кристаллической решеткой.
Характеристика магния с точки зрения физики
Как и все металлы, кроме ртути, данное соединение имеет твердое агрегатное состояние в нормальных условиях. Оно обладает светло-серой окраской со своеобразным блеском. Данный металл имеет довольно высокую прочность. На этом физическая характеристика магния не заканчивается. Рассмотрим температуру плавления и кипения. Первая равняется шестисот пятидесяти градусам по шкале Цельсия, вторая составляет тысяча девяносто градусов Цельсия. Можно сделать вывод, что это достаточно легкоплавкий металл. Кроме того, он очень легкий: его плотность — 1,7 г/см3.
Рассмотрим температуру плавления и кипения. Первая равняется шестисот пятидесяти градусам по шкале Цельсия, вторая составляет тысяча девяносто градусов Цельсия. Можно сделать вывод, что это достаточно легкоплавкий металл. Кроме того, он очень легкий: его плотность — 1,7 г/см3.
Магний. Химия
Зная физические особенности данного вещества, можно перейти ко второй части его характеристики. Данный металл обладает средним уровнем активности. Это можно увидеть из электрохимического ряда металлов — чем пассивнее он, тем правее находится. Магний является одним из первых слева. Рассмотрим по порядку, с какими веществами он реагирует и как это происходит.
С простыми
К таковым относятся те, молекулы которых состоят только из одного химического элемента. Это и кислород, и фисфор, и сера, и многие другие. Сначала рассмотрим взаимодействие с оксигеном. Оно называется горением. При этом образуется оксид данного металла. Если сжечь два моля магния, потратив при этом один моль кислорода, получим два моля оксида. Уравнение данной реакции записывается следующим образом: 2Mg + О2 = 2MgO. Кроме того, при горении магния на открытом воздухе образуется также его нитрид, так как данный металл параллельно реагирует с азотом, содержащимся в атмосфере.
При сжигании трех молей магния тратится один моль нитрогена, и в результате получаем один моль нитрида рассматриваемого металла. Уравнение такого рода химического взаимодействия можно записать таким образом: 3Mg + N2 = Mg3N2.

Кроме того, магний способен реагировать и с другими простыми веществами, такими как галогены. Взаимодействие с ними происходит только при условии нагревания компонентов до очень высоких температур. В таком случае происходит реакция присоединения. К галогенам относятся такие простые вещества: хлор, йод, бром, фтор. И реакции называются соответствующе: хлорирование, йодирование, бромирование, фторирование. Как уже можно было догадаться, в результате таких взаимодействий можно получить хлорид, йодид, бромид, фторид магния. К примеру, если взять один моль магния и столько же йода, получим один моль йодида данного металла. Выразить эту химическую реакцию можно с помощью следующего уравнения: Mg + І2 = MgI2. По такому же принципу проводится и хлорирование. Вот уравнение реакции: Mg + Cl2 = MgCl2.
Кроме этого, металлы, в том числе и магний, реагируют с фосфором и серой. В первом случае можно получить фосфид, во втором — сульфид (не путать с фосфатами и сульфатами!). Если взять три моля магния, добавить к нему два моля фосфора и разогреть до нужной температуры, образуется один моль фосфида рассматриваемого металла. Уравнение данной химической реакции выглядит следующим образом: 3Mg + 2Р = Mg3P2. Точно так же, если смешать магний и серу в одинаковых молярных пропорциях и создать необходимые условия в виде высокой температуры, получим сульфид данного металла. Уравнение подобного химического взаимодействия можно записать так: Mg + S = MgS. Вот мы и рассмотрели реакции этого металла с другими простыми веществами. Но химическая характеристика магния на этом не заканчивается.
Реакции со сложными соединениями
К таким веществам относятся вода, соли, кислоты. С разными группами химических веществ металлы реагируют по-разному. Рассмотрим все по порядку.
Магний и вода
При взаимодействии данного металла с самым распространенным химическим соединением на Земле образуется оксид и водород в виде газа с резким неприятным запахом. Для проведения такого рода реакции компоненты также нужно нагреть. Если смешать по одному молю магния и воды, получим по столько же оксида и водорода. Уравнение реакции записывается следующим образом: Mg + Н2О = MgO + Н2.
Взаимодействие с кислотами
Как и другие химически активные металлы, магний способен вытеснять атомы гидрогена из их соединений. Такого рода процессы называются реакциями замещения. В таких случаях происходит замена атомами металлов атомов гидрогена и формирование соли, состоящей из магния (или другого элемента) и кислотного осадка. Например, если взять один моль магния и добавить его к соляной кислоте в количестве два моля, образуется один моль хлорида рассматриваемого металла и столько же водорода. Уравнение реакции будет выглядеть так: Mg + 2HCl = MgCl2 + Н2.
Взаимодействие с солями
Как из кислот образуются соли, мы уже рассказали, но характеристика магния с точки зрения химии подразумевает и рассмотрение его реакций с солями. В данном случае взаимодействие может произойти, только если металл, входящий в состав соли, менее активен, чем магний. К примеру, если взять по одному молю магния и сульфата меди, получим сульфат рассматриваемого металла и чистую медь в равном молярном соотношении. Уравнение такого рода реакции можно записать в следующем виде: Mg + CuSO4 = MgSO4 + Cu. Здесь проявляются восстановительные свойства магния.
Применение данного металла
Благодаря тому что он по многим параметрам превосходит алюминий — легче его приблизительно в три раза, но при этом в два раза прочнее, он получил широкое распространение в различных отраслях промышленности. В первую очередь это авиастроение. Здесь сплавы на основе магния занимают первое место по популярности среди всех используемых материалов. Кроме того, он используется в химической промышленности в качестве восстановителя для добывания некоторых металлов из их соединений. Благодаря тому что при горении магний образует очень мощную вспышку, его используют в военной промышленности для изготовления сигнальных ракет, светошумовых боеприпасов и др.
Получение магния
В основном сырьем для этого служит хлорид рассматриваемого металла. Делается это путем электролиза.
Качественная реакция на катионы данного металла
Это специальная процедура, предназначенная для того, чтобы определить присутствие ионов какого-либо вещества. Чтобы протестировать раствор на наличие соединений магния, можно добавить к нему карбонат калия или натрия. В результате образуется белый осадок, который легко растворяется в кислотах.
Где этот металл можно найти в природе?
Данный химический элемент является довольно распространенным в природе. Земная кора почти на два процента состоит из этого металла. Он встречается в составе многих минералов, таких как карналлит, магнезит, доломит, тальк, асбест. Формула первого минерала выглядит так: KCl•MgCl2•6Н2О. Он выглядит как кристаллы голубоватого, бледно-розового, блекло-красного, светло-желтого либо прозрачного цвета. Магнезит — это карбонат магния, его химическая формула — MgCO3. Он имеет белую окраску, но в зависимости от примесей, может иметь серый, бурый или желтый оттенок. Доломит имеет следующую химическую формулу: MgCO3•СаСО3. Это желтовато-серый либо цвета охры минерал, обладающий стеклянным блеском.
Магнезит — это карбонат магния, его химическая формула — MgCO3. Он имеет белую окраску, но в зависимости от примесей, может иметь серый, бурый или желтый оттенок. Доломит имеет следующую химическую формулу: MgCO3•СаСО3. Это желтовато-серый либо цвета охры минерал, обладающий стеклянным блеском.
Тальк и асбест имеют более сложные формулы: 3MgO•4SiO2•Н2О и 3MgO•2SiO2•2Н2О соответственно. Благодаря своей высокой жароустойчивости они широко используются в промышленности. Кроме того, магний входит в химический состав клетки и структуру многих органических веществ. Это мы рассмотрим подробнее.
Роль магния для организма
Данный химический элемент важен как для растительных, так и для животных существ. Магний для организма растений просто жизненно необходим. Так же, как железо является основой гемоглобина, нужного для жизни животных, так магний представляет собой главный компонент хлорофилла, без которого не может существовать растение. Данный пигмент участвует в процессе фотосинтеза, при котором в листьях синтезируются из неорганических соединений питательные вещества. Магний для организма животных также очень нужен. Массовая доля данного микроэлемента в клетке — 0,02-0,03%. Несмотря на то что его так мало, он выполняет очень важные функции. Благодаря ему поддерживается структура таких органоидов, как митохондрии, отвечающие за клеточное дыхание и синтез энергии, а также рибосомы, в которых образуются белки, необходимые для жизнедеятельности. Кроме того, он входит в химический состав многих ферментов, которые нужны для внутриклеточного обмена веществ и синтеза ДНК.
Магний для организма животных также очень нужен. Массовая доля данного микроэлемента в клетке — 0,02-0,03%. Несмотря на то что его так мало, он выполняет очень важные функции. Благодаря ему поддерживается структура таких органоидов, как митохондрии, отвечающие за клеточное дыхание и синтез энергии, а также рибосомы, в которых образуются белки, необходимые для жизнедеятельности. Кроме того, он входит в химический состав многих ферментов, которые нужны для внутриклеточного обмена веществ и синтеза ДНК.
Для организма в целом магний необходим, чтобы принимать участие в обмене глюкозы, жиров и некоторых аминокислот. Также с помощью данного микроэлемента может передаваться нервный сигнал. Кроме всего вышеперечисленного, достаточное содержание магния в организме снижает риск сердечных приступов, инфарктов и инсультов.
Симптомы повышенного и пониженного содержания в организме человека
Недостаток магния в организме проявляется такими основными признаками, как повышенное артериальное давление, усталость и низкая работоспособность, раздражительность и плохой сон, ухудшение памяти, частое головокружение. Также может наблюдаться тошнота, судороги, дрожь в пальцах, спутанность сознания — это признаки очень пониженного уровня поступления с едой данного микроэлемента.  Недостаток магния в организме приводит к частым респираторным заболеваниям, нарушениям в работе сердечно-сосудистой системы, а также диабету второго типа. Далее рассмотрим содержание магния в продуктах. Чтобы избежать его недостатка, нужно знать, какая еда богата данным химическим элементом. Нужно учитывать еще и то, что многие из этих симптомов могут проявляться и при обратном случае — избытке магния в организме, а также при недостатке таких микроэлементов, как калий и натрий. Поэтому важно внимательно пересмотреть свой рацион и разобраться в сути проблемы, лучше всего это сделать с помощью специалиста-диетолога.
Недостаток магния в организме приводит к частым респираторным заболеваниям, нарушениям в работе сердечно-сосудистой системы, а также диабету второго типа. Далее рассмотрим содержание магния в продуктах. Чтобы избежать его недостатка, нужно знать, какая еда богата данным химическим элементом. Нужно учитывать еще и то, что многие из этих симптомов могут проявляться и при обратном случае — избытке магния в организме, а также при недостатке таких микроэлементов, как калий и натрий. Поэтому важно внимательно пересмотреть свой рацион и разобраться в сути проблемы, лучше всего это сделать с помощью специалиста-диетолога.
Содержание магния в продуктах
Как было упомянуто выше, данный элемент является основной составляющей хлорофилла. Поэтому можно догадаться, что большое его количество содержится в зелени: это сельдерей, укроп, петрушка, цветная и белокочанная капуста, листья салата и т. д. Также это многие крупы, в особенности гречка и пшено, а еще овсянка и ячневая. Кроме того, данным микроэлементом богаты орехи: это и кешью, и грецкий орех, и арахис, и фундук, и миндаль. Также большое количество рассматриваемого металла содержится в бобовых, таких как фасоль и горох.  Немало его содержится и в составе водорослей, к примеру в морской капусте. Если употребление данных продуктов происходит в нормальном количестве, то ваш организм не будет испытывать недостатка в рассмотренном в этой статье металле. Если же у вас нет возможности регулярно кушать еду, перечисленную выше, то лучше всего приобрести пищевые добавки, в состав которых входит этот микроэлемент. Однако перед этим нужно обязательно проконсультироваться с врачом.
Немало его содержится и в составе водорослей, к примеру в морской капусте. Если употребление данных продуктов происходит в нормальном количестве, то ваш организм не будет испытывать недостатка в рассмотренном в этой статье металле. Если же у вас нет возможности регулярно кушать еду, перечисленную выше, то лучше всего приобрести пищевые добавки, в состав которых входит этот микроэлемент. Однако перед этим нужно обязательно проконсультироваться с врачом.
Вывод
Магний — один из самых важных металлов в мире. Он нашел широкое применение в многочисленных отраслях промышленности — от химической до авиационной и военной. Более того, он очень важен с биологической точки зрения. Без него невозможно существование ни растительных, ни животных организмов. Благодаря данному химическому элементу, осуществляется процесс, дающий жизнь всей планете, — фотосинтез.
fb.ru
Технические характеристики MG / МГ, справочник по MG / МГ, автокаталог, каталог авто.
История марки MG
Одним из основателей британской автомобильной промышленности был Уильям Моррис (1877-1963 гг.). Он начал свою карьеру в 90-х годах прошлого века в качестве механика по мотоциклам, а затем переключился на торговлю новыми автомобилями. На данном поприще Моррис добился немалых успехов и к 1910 году стал владельцем предприятия «Моррис Гараж» — самого крупного в Оксфорде автомобильного дилера. Три года спустя он осуществил еще одну свою задумку — в городке Коулер под Оксфордом был выпущен первый автомобиль марки «Моррис».
После первой мировой войны машины «Моррис» приобрели огромную популярность в Великобритании. Их отличала полукруглая фальшрадиаторная решетка, за которую «Моррисы» называли «тупоносыми» (bullnose). На рынке предлагали две очень похожие модели — «Коулей» с 1,5-литровым двигателем мощностью 12 л.с. и более представительский 1,8-литровый 14-сильный «Оксфорд».
Уильям Моррис все свое внимание и усердие уделял производству автомашин, поэтому «гаражный» бизнес передал в руки главного менеджера. В 1922 году на этот пост назначили Сесила Кимбера — автомобильного энтузиаста, который уже несколько лет проработал в индустрии. Его особенно интересовали спортивные автомобили. У Кимбера были задатки дизайнера: ему удавалось создавать кузова, сразу же притягивавшие к себе внимание. Кроме того, он накопил значительный опыт как конструктор, способный организатор производственной деятельности и удачливый коммерсант. Неудивительно, что ему первому пришла в голову мысль заняться производством новых типов автомобилей на шасси «Моррис».
Позднее он откомментировал свою «пророческую» идею следующим образом: «Я заметил, что существовала реальная возможность продавать на рынках автомобили, которые были бы лишь на 10% лучше обыкновенных, но на 50% их дороже». В 1923 году он установил на стандартном шасси от «Морриса Коулей» 2-местный кузов с ярко выраженными спортивными линиями. В следующем же году Кимбер заказал ателье «Карбодис» изготовление 2- и 4-местных спортивных кузовов. Для новых автомобилей придумали и новую марку «MG». Буквы были заключены в блестящий восьмиугольник. Символ этот стал с тех пор официальным обозначением компании.
4-местный «MG» был оснащен 14-сильным мотором от «Моррис Оксфорд» и имел элегантный кузов, частично составленный из полированных панелей алюминия, оттененных блестящими колесными дисками. Самое удивительное, что автомобиль продавался за 395 фунтов, в то время как стандартный «Моррис Оксфорд» стоил 285 фунтов, 12-сильный «Коулей» — всего 195. Тем не менее «MG» от Кимбера пошла на ура. В начале 1925 года он для себя построил улучшенную версию этого автомобиля. Кимбер использовал значительно модифицированное шасси «Моррис» и измененный двигатель, в котором клапаны располагались не сбоку, а сверху. На этой машине в 1925 году инженер выиграл престижную гонку «Ленд энд Траял». Вскоре версия была продана за 300 фунтов. Через несколько лет MG выкупила модель обратно и с тех пор она известна как «Old Number One» («Старый первый номер») и считается первым спортивным автомобилем от MG. Само же название марки является производным, как Кимбер позднее заметил, от имени первого предприятия Уильяма Морриса — «Моррис Гараж». Инициалы его положили начало первой в истории Великобритании спортивной автомобильной фирмы.
В 1926 году известные «тупоносые» «Моррисы» были заменены на так называемые «плосконосые», то есть имевшие радиаторные решетки обыкновенной формы. Кузова новых автомобилей «подхватили» спортивную тему, инициированную «MG».
В 1927 году производство «MG» было впервые перенесено в специально построенное здание на Эдмонд Роуд в Коулей. В 1928 году «МG Кар Компани» была официально учреждена и бизнес начал отделяться от традиционного «Моррис Гараж». К концу этого года к серийному производству были готовы еще две модели компании. Первой из них был «MG 18/80» — 6-цилиндровый автомобиль с 2,5-литровым верхневальным двигателем. Предлагавшаяся с открытым или закрытым кузовом «18/80» была отличной спортивной машиной, однако стоила недешево, поэтому никогда не производилась в больших количествах. Позднейшая версия «Марк 11» имела шасси нового дизайна и 4-ступенчатую КПП. Ее изготавливали в ограниченном количестве до 1933 года. В 1930 году «Моррис» представил еще один гоночный вариант автомобиля — «Марк 111 18/100», или «Тигрица». Стоимость ее равнялась 895 фунтам, и не удивительно, что было изготовлено всего пять экземпляров.
Однако гораздо более важным событием в 1928 году стала премьера «MG-Миджет», или «М-type». Она базировалась на недавно представленном маленьком автомобиле «Моррис-Минор». 0,8-литровый двигатель и шасси были заимствованы практически полностью. А вот кузов сильно отличался. 2-местный родстер стоил 175 фунтов, поэтому он был относительно доступным. Журнал «Автокар» объявил тогда, что «MG-Миджет» «сотворит историю спортивных автомобилей Британии».
«Миджет» пошел в серийное производство в марте 1929 года. Успех этой модели вынудил в очередной раз увеличить производственные мощности компании. В конце 1929 года MG купила часть заводских площадей предприятия кожаных изделий Павловой в городке Абингдон, что в нескольких милях южнее Оксфорда. Абингдон стал резиденцией компании MG на следующие 50 лет. Главным держателем акций по-прежнему был Уильям Моррис, а талантливый Сесил Кимбер остался руководить предприятием.
В период с 1930 по 1934 годы MG становится ведущим производителем спортивных автомобилей в Великобритании. В 1930 компания построила для Джорджа Айстона гоночный суперкар, не раз побивавший рекорды скорости в своем классе. Фирма занималась производством и других специализированных гоночных машин. Кроме вышеупомянутого «Марка 111», была собрана версия «Double Twelwe» модели «Миджет», которая взяла главный приз в гонке 1930 года в Брукленде. Машина Айстона «ЕХ-180» послужила базой, на которой построили турбонаддувный гоночный «C-type» 1931 года. В конце этого же года появилась модель «F-type Магна», использовавшая 1,3-литровый 6-цилиндровый двигатель малых размеров. Он представлял из себя версию тогдашнего мотора от «Волсей Хорнет» — еще одной ветви могущественной автомобильной империи «Моррис». Был также построен «D-type» — 4-местный «Миджет», однако и он, и «M-type» в 1932 году уступили дорогу новому «J-type». На нем Кимбер показал черты дизайна, которые стали отличительной принадлежностью автомобилей «MG»: разделенная пополам решетка радиатора, плоское складывающееся вперед лобовое стекло, большие вырезы в передних дверях, бензобак и запасное колесо, расположенные сзади. Вначале колесные арки у машин были «велосипедного» типа, однако в дальнейшем они слились с кузовом с образованием мягких, текущих форм, что также стало характерной частью внешнего вида «MG».
В начале 1933 года вышел очередной новый тип — «K-type Магнет» с еще меньшим, 1,1-литровым 6-цилиндровым, двигателем. На длиннобазные модели фирма ставила кузова 4-дверных седанов. Однако самой популярной «Магнет» стала «К3» — гоночная модель с коротким шасси и двигателем с турбонаддувом. В 1933 году она взяла командный приз в итальянском ралли Милле Милья, а в 1934-м пришла четвертой к финишу в популярной 24-часовой гонке в Ле-Мане. В 1933 году итальянский гонщик Тацио Нуволари дважды выиграл на «К3» гонку «Турист Трофи». С 1933 по 1935 годы MG построила еще пять спортивных автомобилей на базе моделей «Миджет», «Магна» и «Магнет».
В 1935 году фирма перешла из частного владения Уильяма Морриса в распоряжение компании «Моррис Моторс». Вскоре после этого она объявила, что прекращает производство спортивных моделей.
Новые автомобили от MG 1935-1939 годов были технически тесно связаны с производственным рядом «Моррис-Волселей». Модель «SA», представленная в 1935 году, была комфортабельным 6-цилиндровым седаном с 2-литровым двигателем, объем которого был вскоре увеличен до 2,3 литра. Машина благодаря элегантности и динамике стала соперником «Ягуаров». Спустя некоторое время появилась «VA» с двигателем объемом 1,5 литра, а в 1938 году на суд зрителей MG представила 2,6-литровую «WA» — самый большой седан компании…
Так, не претендуя на мировое господство, MG дожила до наших дней, вошла в состав Rover Group. В настоящее время фирма работает на полную мощность. Потребителями MG являются достаточно состоятельные жители Альбиона, неравнодушные к дизайну 30-х годов.
www.autonet.ru
Характерные химические свойства Be, Mg и щелочноземельных металлов » HimEge.ru
 К семейству щёлочноземельных элементов относят кальций, стронций, барий и радий. Д. И. Менделеев включал в это семейство и магний. Щёлочноземельными элементы именуются по той причине, что их гидроксиды, подобно гидроксидам щелочных металлов, растворимы в воде, т. е. являются щелочами. «…Земельными же они названы потому, что в природе они встречаются в состоянии соединений, образующих нерастворимую массу земли, и сами в виде окисей RO имеют землистый вид», — пояснял Менделеев в «Основах химии».
К семейству щёлочноземельных элементов относят кальций, стронций, барий и радий. Д. И. Менделеев включал в это семейство и магний. Щёлочноземельными элементы именуются по той причине, что их гидроксиды, подобно гидроксидам щелочных металлов, растворимы в воде, т. е. являются щелочами. «…Земельными же они названы потому, что в природе они встречаются в состоянии соединений, образующих нерастворимую массу земли, и сами в виде окисей RO имеют землистый вид», — пояснял Менделеев в «Основах химии».Общая характеристика элементов II а группы
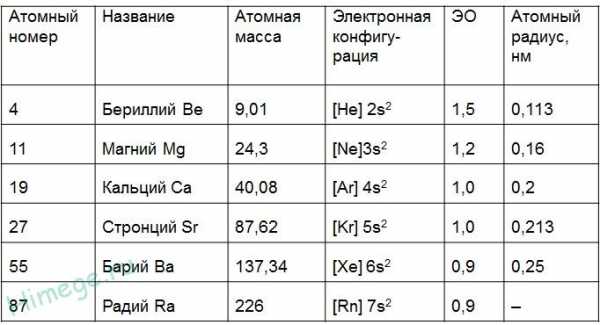
•Металлы главной подгруппы II группы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами.
• Легко отдают два валентных электрона, и во всех соединениях имеют степень окисления +2
• Сильные восстановители
•Активность металлов и их восстановительная способность увеличивается в ряду: Be–Mg–Ca–Sr–Ba
• К щёлочноземельным металлам относят только кальций, стронций, барий и радий, реже магний
• Бериллий по большинству свойств ближе к алюминию
Физические свойства простых веществ
Щелочноземельные металлы (по сравнению со щелочными металлами) обладают более высокими t°пл. и t°кип., потенциалами ионизации, плотностями и твердостью.
Химические свойства щелочноземельных металлов + Be
1. Реакция с водой.
В обычных условиях поверхность Be и Mg покрыты инертной оксидной пленкой, поэтому они устойчивы по отношению к воде. В отличие от них Ca, Sr и Ba растворяются в воде с образованием щелочей:
Mg + 2H2O –t°→ Mg(OH)2 + H2↑
Ca + 2H2O → Ca(OH)2 + H2↑
2. Реакция с кислородом.
Все металлы образуют оксиды RO, барий-пероксид – BaO2:
2Mg + O2 → 2MgO
Ba + O2 → BaO2
3. С другими неметаллами образуют бинарные соединения:
Be + Cl2 → BeCl2 (галогениды)
Ba + S → BaS (сульфиды)
3Mg + N2 → Mg3N2 (нитриды)
Ca + H2 → CaH2 (гидриды)
Ca + 2C → CaC2 (карбиды)
3Ba + 2P → Ba3P2 (фосфиды)
Бериллий и магний сравнительно медленно реагируют с неметаллами.
4. Все щелочноземельные металлы растворяются в кислотах:
Ca + 2HCl → CaCl2 + H2
Mg + H2SO4(разб.) → MgSO4 + H2
5. Бериллий растворяется в водных растворах щелочей:
Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
6. Летучие соединения щёлочноземельных металлов придают пламени характерный цвет:
соединения кальция — кирпично-красный, стронция — карминово-красный, а бария — желтовато-зелёный.

 Бериллий, также как и литий, относится к числу s-элементов. Четвертый электрон, появляющийся в атоме Be, помещается на 2s-орбитали. Энергия ионизации бериллия выше, чем у лития, из-за большего заряда ядра. В сильных основаниях он образует ион-бериллат ВеО2-2. Следовательно, бериллий ‑ металл, но его соединения обладают амфотерностью. Бериллий, хотя и металл, но значительно менее электроположительный, по сравнению с литием.
Бериллий, также как и литий, относится к числу s-элементов. Четвертый электрон, появляющийся в атоме Be, помещается на 2s-орбитали. Энергия ионизации бериллия выше, чем у лития, из-за большего заряда ядра. В сильных основаниях он образует ион-бериллат ВеО2-2. Следовательно, бериллий ‑ металл, но его соединения обладают амфотерностью. Бериллий, хотя и металл, но значительно менее электроположительный, по сравнению с литием.
Высокой энергией ионизации атома бериллий заметно отличается от остальных элементов ПА-подгруппы (магния и щелочноземельных металлов). Его химия во многом сходна с химией алюминия (диагональное сходство). Таким образом, это элемент с наличием у его соединений амфотерных качеств, среди которых преобладают все же основные.
Электронная конфигурация Mg: 1s22s22p63s2 по сравнению с натрием имеет одну существенную особенность: двенадцатый электрон помещается на 2s-орбитали, где уже имеется 1е—.
Ионы магния и кальция ‑ незаменимые элементы жизнедеятельности любой клетки. Их соотношение в организме должно быть строго определённым. Ионы магния участвуют в деятельности ферментов (например, карбоксилазы), кальция – в построении скелета и обмена веществ. Повышение содержания кальция улучшает усвоение пищи. Кальций возбуждает и регулирует работу сердца. Его избыток резко усиливает деятельность сердца. Магний играет отчасти роль антагониста кальция. Введение ионов Mg2+ под кожу вызывает наркоз без периода возбуждения, паралич мышц, нервов и сердца. Попадая в рану в форме металла, он вызывает долго незаживающие гнойные процессы. Оксид магния в лёгких вызывает так называемую литейную лихорадку. Частый контакт поверхности кожи с его соединениями приводит к дерматитам. Самые широко используемые в медицине соли кальция: сульфат СаSO4 и хлорид CaCL2. Первый используется для гипсовых повязок, а второй применяется для внутривенных вливаний и как внутреннее средство. Он помогает бороться с отёками, воспалениями, аллергией, снимает спазмы сердечно-сосудистой системы, улучшает свертываемость крови.
Все соединения бария, кроме BaSO4, ядовиты. Вызывают менегоэнцефалит с поражением мозжечка, поражение гладких сердечных мышц, паралич, а в больших дозах – дегенеративные изменения печени. В малых же дозах соединения бария стимулируют деятельность костного мозга.
При введении в желудок соединений стронция наступает его расстройство, паралич, рвота; поражения по признакам сходны с поражениями от солей бария, но соли стронция менее токсичны. Особую тревогу вызывает появление в организме радиоактивного изотопа стронция 90Sr. Он исключительно медленно выводится из организма, а его большой период полураспада и, следовательно, длительность действия могут служить причиной лучевой болезни.
Радий опасен для организма своим излучением и огромным периодом полураспада (Т1/2 = 1617 лет). Первоначально после открытия и получения солей радия в более или менее чистом виде его стали использовать довольно широко для рентгеноскопии, лечения опухолей и некоторых тяжёлых заболеваний. Теперь с появлением других более доступных и дешевых материалов применение радия в медицине практически прекратилось. В некоторых случаях его используют для получения радона и как добавку в минеральные удобрения.
В атоме кальция завершается заполнение 4s-орбитали. Вместе с калием он образует пару s-элементов четвертого периода. Гидроксид кальция ‑ довольно сильное основание. У кальция — наименее активного из всех щелочноземельных металлов — характер связи в соединениях ионный.
По своим характеристикам стронций занимает промежуточное положение между кальцием и барием.
Свойства бария наиболее близки к свойствам щелочных металлов.
Бериллий и магний широко используют в сплавах. Бериллиевые бронзы – упругие сплавы меди с 0,5-3% бериллия; в авиационных сплавах (плотность 1,8) содержится 85-90% магния («электрон»). Бериллий отличается от остальных металлов IIА группы – не реагирует с водородом и водой, зато растворяется в щелочах, поскольку образует амфотерный гидроксид:
Be+H2O+2NaOH=Na2[Be(OH)4]+H2.
Магний активно реагирует с азотом:
3 Mg + N2 = Mg3N2 .
В таблице приведена растворимость гидроксидов элементов II группы.
| Растворимость, моль/л (200С) | Растворимость, г/л | |
| Be(OH)2 Mg(OH)2 Ca(OH)2 Sr(OH)2 Ba(OH)2 | 8∙10-6 5∙10-4 2∙10-2 7∙10-2 2∙10-1 | 3,4∙10-4 2,9∙10-2 1,5 8,5 34,2 |
Традиционная техническая проблема – жесткость воды, связанная с наличием в ней ионов Mg2+ и Ca2+ . Из гидрокарбонатов и сульфатов на стенках нагревательных котлов и труб с горячей водой оседают карбонаты магния и кальция и сульфат кальция. Особенно мешают они работе лабораторных дистилляторов.
S-элементы в живом организме выполняют важную биологическую функцию. В таблице приведено их содержание.
Содержание S-элементов в организме человека
| Элемент | Содержание, % |
| Li Na K Rb Cs Be Mg Ca Sr Ba | 10-4 0,08 0,23 10-5 10-4 10-7 0,027 1,4 10-3 10-5 |
Во внеклеточной жидкости содержится в 5 раз больше ионов натрия, чем внутри клеток. Изотонический раствор («физиологическая жидкость») содержит 0,9% хлорида натрия, его применяют для инъекций, промывания ран и глаз и т. п. Гипертонические растворы (3-10% хлорида натрия) используют как примочки при лечении гнойных ран («вытягивание» гноя). 98% ионов калия в организме находится внутри клеток и только 2% во внеклеточной жидкости. В день человеку нужно 2,5-5 г калия. В 100 г кураги содержится до 2 г калия. В 100 г жареной картошки – до 0,5 г калия. Во внутриклеточных ферментативных реакциях АТФ и АДФ участвуют в виде магниевых комплексов.
Ежедневно человеку требуется 300-400 мг магния. Он попадает в организм с хлебом (90 мг магния на 100 г хлеба), крупой (в 100 г овсяной крупы до 115 мг магния), орехами (до 230 мг магния на 100 г орехов). Кроме построения костей и зубов на основе гидроксилапатита Ca10(PO4)6(OH)2 , катионы кальция активно участвуют в свертывании крови, передаче нервных импульсов, сокращении мышц. В сутки взрослому человеку нужно потреблять около 1 г кальция. В 100 г твердых сыров содержится 750 мг кальция; в 100 г молока – 120 мг кальция; в 100 г капусты – до 50 мг.

himege.ru

